Rapport sur le marché européen des essais cliniques (2021-2031) par périmètre, segmentation, dynamique et analyse concurrentielle
No. of Pages: 136 | Report Code: BMIRE00028989 | Category: Life Sciences
No. of Pages: 136 | Report Code: BMIRE00028989 | Category: Life Sciences
La taille du marché européen des essais cliniques devrait atteindre 20 056,53 millions de dollars américains d'ici 2031, contre 12 286,73 millions de dollars américains en 2023. Le marché devrait enregistrer un TCAC de 6,3 % de 2023 à 2031.
Le marché européen des essais cliniques est segmenté entre le Royaume-Uni, la France, l'Allemagne, l'Italie, l'Espagne, la Pologne, la Suisse, la Suède, le Danemark, la Belgique, les Pays-Bas et le reste de l'Europe. L'augmentation du nombre d'essais cliniques pour le développement de nouveaux médicaments et le lancement de produits innovants par les entreprises devrait stimuler la croissance du marché en Europe au cours de la période de prévision .
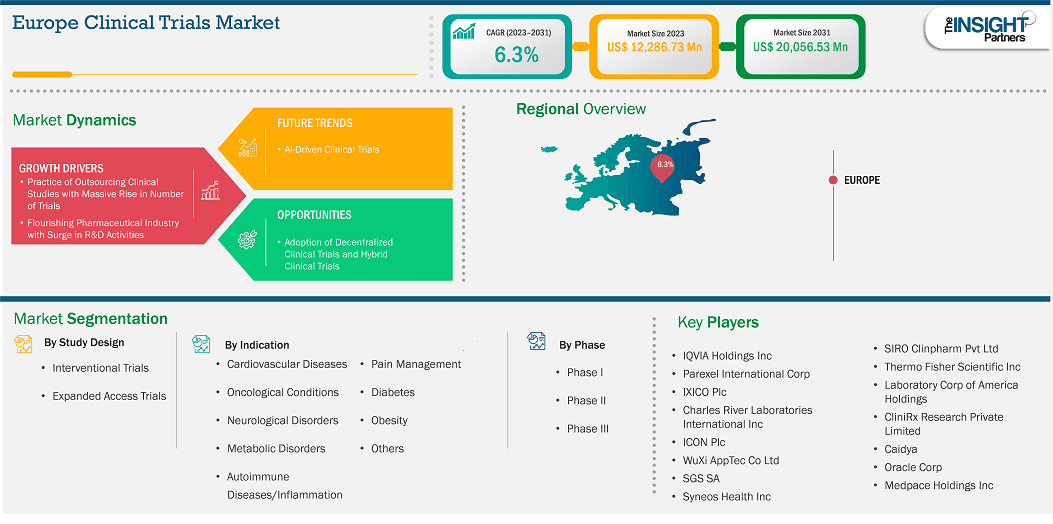
Les segments clés qui ont contribué à l’élaboration de l’analyse du marché des essais cliniques en Europe sont la conception de l’étude, les indications et le type de phase.
Les sujets inscrits à des essais cliniques décentralisés (ECD) n'ont pas besoin de se rendre fréquemment sur les sites d'essais hospitaliers. Dans les ECD, les technologies numériques sont utilisées pour permettre l'accès des patients à la recherche clinique, la collecte et le suivi des données à distance, et la communication entre les investigateurs et les participants. Une approche d'essai clinique hybride combine des activités à domicile et sur site, offrant une expérience patient optimale et respectant des protocoles complexes, gagnant en popularité dans divers domaines thérapeutiques et parcours de phase d'essai. Initialement, l'adoption des ECD a été freinée par des défis tels que la confidentialité des patients, la sécurité des données, les obstacles réglementaires et la complexité des protocoles. Cependant, la pandémie de COVID-19 a contraint les promoteurs d'essais cliniques à adopter des techniques cliniques décentralisées et hybrides pour le développement de médicaments, les études en présentiel n'étant pas réalisables dans le contexte de cette crise sanitaire. Avec les restrictions imposées sur les déplacements, la seule façon de collecter des données et de poursuivre les essais était de travailler à distance et d'optimiser l'utilisation des technologies pour accélérer les processus. Selon les données fournies par McKinsey, environ 70 % des participants potentiels aux essais cliniques restent éloignés des sites d'essai. Par conséquent, la décentralisation élargit l’accès aux essais pour atteindre un plus grand nombre de sujets, constitué d’un groupe de patients potentiellement plus diversifié.
Les essais cliniques hybrides permettent aux promoteurs d'intégrer stratégiquement des éléments de DCT dans leurs plans d'étude. Ces modèles d'essais offrent une flexibilité sans précédent ; de plus en plus d'entreprises s'y intéressent, ce qui redéfinit le paysage du secteur. Selon ObvioHealth, la FDA prévoyait de dévoiler des protocoles pour soutenir l'utilisation des méthodes de DCT en 2023 afin de renforcer la crédibilité des futures recherches cliniques. Ainsi, l'intérêt croissant pour les essais cliniques décentralisés et hybrides, par rapport aux méthodes traditionnelles, devrait offrir des opportunités lucratives pour le marché des essais cliniques au cours de la période de prévision.
Par pays, le marché européen des essais cliniques comprend le Royaume-Uni, l'Allemagne, la France, l'Espagne, l'Italie, la Pologne, la Suisse, la Suède, le Danemark, la Belgique, les Pays-Bas et le reste de l'Europe. L'Allemagne détenait la plus grande part en 2023.
Selon Clinical Trials Arena, l'Allemagne a réalisé environ 3,9 % du total des essais cliniques réalisés dans le monde en 2021. De plus, le pays dispose d'un bassin de patients important et d'une forte demande de soins de santé de qualité. Des centres de coordination des essais cliniques ont été créés dans le cadre d'un nouveau programme de financement du ministère fédéral de l'Éducation et de la Recherche afin de favoriser la recherche clinique universitaire. En Allemagne, les essais cliniques sont approuvés par l'Institut fédéral des médicaments et des dispositifs médicaux ou par l'Institut Paul-Ehrlich, selon le produit étudié. Par conséquent, les processus d'approbation des essais cliniques en Allemagne sont standardisés, fiables, transparents et approuvés pour des délais de démarrage d'études relativement courts. De plus, les principales CRO allemandes proposent plusieurs services d'essais cliniques. Sofpromed gère des essais cliniques en Allemagne et dans d'autres États membres de l'UE. Elle offre une gamme complète de services de CRO aux entreprises pharmaceutiques et biotechnologiques. De même, CONET GmbH, dont le siège social est à Mannheim, en Allemagne, propose des services de gestion d'essais cliniques allant de petites études pilotes à de grands essais cliniques internationaux multicentriques pour toutes les phases (1 à 4), y compris les essais cliniques pédiatriques et les essais de dispositifs médicaux conformément aux directives de l'UE.
| Attribut de rapport | Détails |
|---|---|
| Taille du marché en 2023 | 12 286,73 millions de dollars américains |
| Taille du marché d'ici 2031 | 20 056,53 millions de dollars américains |
| TCAC mondial (2023 - 2031) | 6,3% |
| Données historiques | 2021-2022 |
| Période de prévision | 2024-2031 |
| Segments couverts | Par conception d'étude
|
| Régions et pays couverts | Europe
|
| Leaders du marché et profils d'entreprises clés |
|
Parmi les principaux acteurs du marché, on compte QVIA Holdings Inc., Parexel International Corp., IXICO Plc., Charles River Laboratories International Inc., ICON Plc., WuXi AppTec Co. Ltd., SGS SA., Syneos Health Inc., Thermo Fisher Scientific Inc., Laboratory Corp. of America Holdings, CliniRx Research Private Limited, Caidya, Oracle Corp., Medpace Holdings Inc. et SIRO Clinpharm Pvt Ltd. Ces acteurs adoptent diverses stratégies, telles que l'expansion, l'innovation produit et les fusions-acquisitions, pour proposer des produits innovants à leurs consommateurs et accroître leur part de marché.
La méthodologie suivante a été suivie pour la collecte et l’analyse des données présentées dans ce rapport :
Le processus de recherche commence par une étude secondaire approfondie, utilisant des sources internes et externes pour recueillir des données qualitatives et quantitatives pour chaque marché. Les sources d'étude secondaires fréquemment citées incluent, sans s'y limiter :
Remarque : Toutes les données financières présentées dans la section « Profils d'entreprise » ont été normalisées en USD. Pour les entreprises déclarant dans d'autres devises, les chiffres ont été convertis en USD aux taux de change en vigueur pour l'année correspondante.
Chaque année, Insight Partners mène un nombre important d'entretiens préliminaires avec des acteurs et des experts du secteur afin de valider ses analyses de données et d'obtenir des informations précieuses. Ces entretiens de recherche visent à :
L'étude primaire est menée par courriel et par entretiens téléphoniques, auprès de divers marchés, catégories, segments et sous-segments de différentes régions. Les participants sont généralement :
Le marché européen des essais cliniques est évalué à 12 286,73 millions de dollars américains en 2023 et devrait atteindre 20 056,53 millions de dollars américains d'ici 2031.
Selon notre rapport sur le marché européen des essais cliniques, la taille du marché est évaluée à 12 286,73 millions de dollars américains en 2023, et devrait atteindre 20 056,53 millions de dollars américains d'ici 2031. Cela se traduit par un TCAC d'environ 6,3 % au cours de la période de prévision.
Le rapport sur le marché européen des essais cliniques couvre généralement ces segments clés :
La période historique, l'année de référence et la période de prévision peuvent varier légèrement selon le rapport d'étude de marché concerné. Cependant, pour le rapport sur le marché européen des essais cliniques :
Période historique : 2021-2022 Année de base : 2023 Période de prévision : 2024-2031Le marché européen des essais cliniques compte plusieurs acteurs clés, chacun contribuant à sa croissance et à son innovation. Parmi les principaux acteurs, on peut citer :
QVIA Holdings Inc. Parexel International Corp. IXICO Plc. Charles River Laboratories International Inc. ICON Plc. WuXi AppTec Co. Ltd. SGS SAS. Syneos Health Inc. Thermo Fisher Scientific Inc. Laboratory Corp of America Holdings. CliniRx Research Private Limited. Caidya. Oracle Corp. Medpace Holdings Inc. SIRO Clinpharm Pvt Ltd. QVIA Holdings Inc.Le rapport sur le marché européen des essais cliniques est utile à diverses parties prenantes, notamment :
Essentiellement, toute personne impliquée ou envisageant de s’impliquer dans la chaîne de valeur du marché européen des essais cliniques peut bénéficier des informations contenues dans un rapport de marché complet.