Marktbericht für klinische Studien in Europa (2021-2031) nach Umfang, Segmentierung, Dynamik und Wettbewerbsanalyse
No. of Pages: 136 | Report Code: BMIRE00028989 | Category: Life Sciences
No. of Pages: 136 | Report Code: BMIRE00028989 | Category: Life Sciences
Der europäische Markt für klinische Studien dürfte von 12.286,73 Millionen US-Dollar im Jahr 2023 auf 20.056,53 Millionen US-Dollar im Jahr 2031 anwachsen. Von 2023 bis 2031 wird für den Markt eine durchschnittliche jährliche Wachstumsrate (CAGR) von 6,3 % erwartet.
Der europäische Markt für klinische Studien ist in Großbritannien, Frankreich, Deutschland, Italien, Spanien, Polen, die Schweiz, Schweden, Dänemark, Belgien, die Niederlande und das übrige Europa unterteilt. Die zunehmende Anzahl klinischer Studien zur Entwicklung neuer Medikamente und zur Einführung innovativer Produkte durch Unternehmen dürfte das Marktwachstum in Europa im Prognosezeitraum ankurbeln .
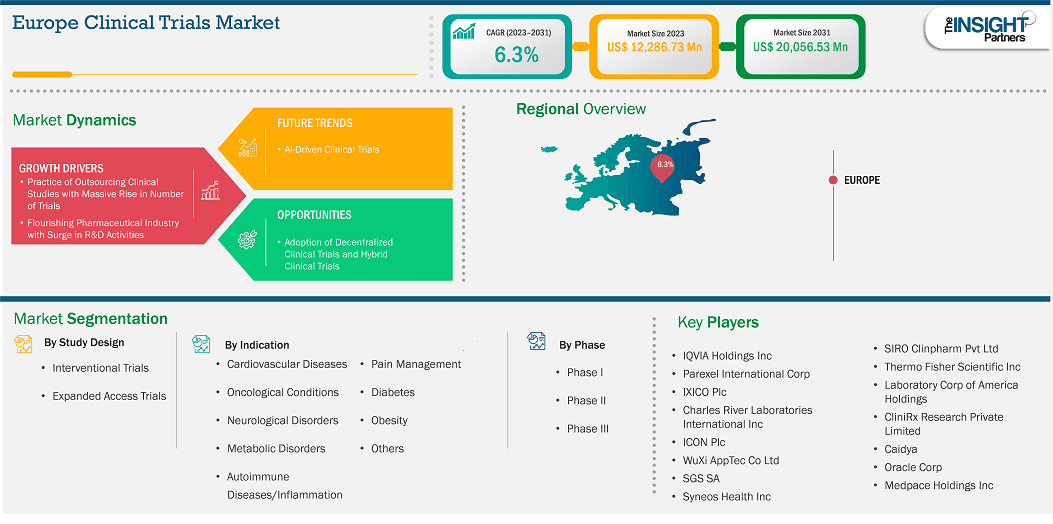
Wichtige Segmente, die zur Ableitung der Analyse des europäischen Marktes für klinische Studien beigetragen haben, sind Studiendesign, Indikationen und Phasentyp.
Probanden dezentraler klinischer Studien (DCT) müssen nicht häufig die Prüfzentren in Krankenhäusern aufsuchen. In DCTs werden digitale Technologien eingesetzt, um Patienten Zugang zu klinischen Forschungsprojekten, die Fernerfassung und -überwachung von Daten sowie die Kommunikation zwischen Prüfern und Teilnehmern zu ermöglichen. Ein hybrider Ansatz für klinische Studien kombiniert Aktivitäten von zu Hause aus und vor Ort, wodurch die Patientenerfahrung optimal gestaltet und komplexe Protokollvorschriften eingehalten werden. Dadurch gewinnt er in verschiedenen Therapiebereichen und Studienphasen an Bedeutung. Anfänglich wurde die Einführung von DCTs durch Herausforderungen wie Patientendatenschutz, Datensicherheit, regulatorische Hürden und komplexe Protokollvorschriften beeinträchtigt. Die COVID-19-Pandemie zwang die Sponsoren klinischer Studien jedoch dazu, dezentrale und hybride klinische Techniken zur Entwicklung von Medikamenten einzuführen, da persönliche Studien angesichts dieser Gesundheitskrise nicht durchführbar waren. Aufgrund der Einschränkungen beim Pendeln konnten Daten nur durch Fernarbeit und die optimale Nutzung von Technologien zur Beschleunigung von Prozessen gesammelt und Studien fortgesetzt werden. Laut den von McKinsey bereitgestellten Daten bleiben etwa 70 % der potenziellen Teilnehmer an klinischen Studien den Prüfzentren fern. Daher wird durch die Dezentralisierung der Zugang zu Studien erweitert, um eine größere Anzahl von Probanden zu erreichen, die möglicherweise aus einem vielfältigeren Patientenpool besteht.
Hybride klinische Studien ermöglichen es Sponsoren, DCT-Elemente strategisch in Studiendesigns zu integrieren. Diese Studienmodelle bieten beispiellose Flexibilität; daher zeigen immer mehr Unternehmen Interesse an Hybridstudien, was die Branche neu definiert. Laut ObvioHealth plante die FDA, im Jahr 2023 Protokolle zur Unterstützung des Einsatzes von DCT-Methoden vorzustellen, um die Glaubwürdigkeit künftiger klinischer Forschung zu erhöhen. Daher wird erwartet, dass der zunehmende Fokus auf dezentrale und hybride klinische Studien gegenüber traditionellen klinischen Studienmethoden im Prognosezeitraum lukrative Möglichkeiten für den Markt für klinische Studien bietet.
Der europäische Markt für klinische Studien umfasst nach Ländern Großbritannien, Deutschland, Frankreich, Spanien, Italien, Polen, die Schweiz, Schweden, Dänemark, Belgien, die Niederlande und das übrige Europa. Deutschland hatte im Jahr 2023 den größten Anteil.
Laut Clinical Trials Arena fanden im Jahr 2021 etwa 3,9 % aller weltweit durchgeführten klinischen Studien in Deutschland statt. Darüber hinaus verfügt das Land über einen großen Patientenpool und eine hohe Nachfrage nach qualitativ hochwertiger Gesundheitsversorgung. Im Rahmen eines neuen Förderprogramms des Bundesministeriums für Bildung und Forschung wurden Koordinierungszentren für klinische Studien eingerichtet, um die akademische klinische Forschung zu fördern. Klinische Studien in Deutschland werden je nach zu untersuchendem Produkt vom Bundesinstitut für Arzneimittel und Medizinprodukte oder dem Paul-Ehrlich-Institut genehmigt. Daher sind die Genehmigungsverfahren für klinische Studien in Deutschland standardisiert, zuverlässig, transparent und für relativ kurze Studienbeginnzeiten zugelassen. Darüber hinaus bieten führende CROs in Deutschland verschiedene Dienstleistungen für klinische Studien an. Sofpromed leitet klinische Studien in Deutschland und anderen EU-Mitgliedsstaaten. Das Unternehmen bietet ein umfassendes Spektrum an CRO-Dienstleistungen für Pharma- und Biotechnologieunternehmen. Ebenso bietet die CONET GmbH mit Hauptsitz in Mannheim, Deutschland, Dienstleistungen im Bereich des klinischen Studienmanagements an, von kleinen Pilotstudien bis hin zu großen multizentrischen internationalen klinischen Studien für alle Phasen (1–4), einschließlich klinischer Studien für Kinder und Studien mit Medizinprodukten gemäß EU-Richtlinien.
| Berichtsattribut | Details |
|---|---|
| Marktgröße im Jahr 2023 | 12.286,73 Millionen US-Dollar |
| Marktgröße bis 2031 | 20.056,53 Millionen US-Dollar |
| Globale CAGR (2023 – 2031) | 6,3 % |
| Historische Daten | 2021-2022 |
| Prognosezeitraum | 2024–2031 |
| Abgedeckte Segmente | Nach Studiendesign
|
| Abgedeckte Regionen und Länder | Europa
|
| Marktführer und wichtige Unternehmensprofile |
|
Zu den wichtigsten Akteuren auf dem Markt zählen unter anderem QVIA Holdings Inc, Parexel International Corp, IXICO Plc, Charles River Laboratories International Inc, ICON Plc, WuXi AppTec Co Ltd, SGS SA, Syneos Health Inc, Thermo Fisher Scientific Inc, Laboratory Corp of America Holdings, CliniRx Research Private Limited, Caidya, Oracle Corp, Medpace Holdings Inc und SIRO Clinpharm Pvt Ltd. Diese Akteure verfolgen verschiedene Strategien wie Expansion, Produktinnovation sowie Fusionen und Übernahmen, um ihren Kunden innovative Produkte anzubieten und ihren Marktanteil zu erhöhen.
Für die Erhebung und Analyse der in diesem Bericht dargestellten Daten wurde die folgende Methodik angewendet:
Der Forschungsprozess beginnt mit einer umfassenden Sekundärforschung. Dabei werden sowohl interne als auch externe Quellen genutzt, um qualitative und quantitative Daten für jeden Markt zu sammeln. Zu den häufig zitierten Sekundärforschungsquellen gehören unter anderem:
Hinweis: Alle Finanzdaten im Abschnitt „Unternehmensprofile“ wurden auf US-Dollar standardisiert. Für Unternehmen, die in anderen Währungen berichten, wurden die Zahlen anhand der entsprechenden Wechselkurse des entsprechenden Jahres in US-Dollar umgerechnet.
The Insight Partners führt jährlich eine große Anzahl von Primärinterviews mit Branchenvertretern und Experten durch, um die Datenanalyse zu validieren und wertvolle Erkenntnisse zu gewinnen. Diese Forschungsinterviews dienen dazu:
Die Primärforschung erfolgt per E-Mail und Telefoninterviews und umfasst verschiedene Märkte, Kategorien, Segmente und Untersegmente in unterschiedlichen Regionen. Zu den Teilnehmern gehören typischerweise:
Der europäische Markt für klinische Studien wird im Jahr 2023 auf 12.286,73 Millionen US-Dollar geschätzt und soll bis 2031 20.056,53 Millionen US-Dollar erreichen.
Laut unserem Bericht „Europa-Markt für klinische Studien“ wird das Marktvolumen im Jahr 2023 auf 12.286,73 Millionen US-Dollar geschätzt und soll bis 2031 20.056,53 Millionen US-Dollar erreichen. Dies entspricht einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von etwa 6,3 % im Prognosezeitraum.
Der Bericht über den europäischen Markt für klinische Studien deckt in der Regel diese Schlüsselsegmente ab:
Der historische Zeitraum, das Basisjahr und der Prognosezeitraum können je nach Marktforschungsbericht leicht variieren. Für den europäischen Marktbericht für klinische Studien gilt jedoch Folgendes:
Historischer Zeitraum: 2021–2022Basisjahr: 2023Prognosezeitraum: 2024–2031Der europäische Markt für klinische Studien ist von mehreren wichtigen Akteuren geprägt, die jeweils zu Wachstum und Innovation beitragen. Zu den wichtigsten Akteuren gehören:
QVIA Holdings IncParexel International CorpIXICO PlcCharles River Laboratories International IncICON PlcWuXi AppTec Co LtdSGS SASyneos Health IncThermo Fisher Scientific IncLaboratory Corp of America HoldingsCliniRx Research Private LimitedCaidyaOracle CorpMedpace Holdings IncSIRO Clinpharm Pvt LtdQVIA Holdings IncDer Bericht zum europäischen Markt für klinische Studien ist für verschiedene Interessengruppen wertvoll, darunter:
Grundsätzlich kann jeder, der an der Wertschöpfungskette des europäischen Marktes für klinische Studien beteiligt ist oder eine Beteiligung daran in Erwägung zieht, von den Informationen eines umfassenden Marktberichts profitieren.